Anticorpo
UTILIZZO E NOMENCLATURA DEGLI ANTICORPI MONOCLONALI
Nella pratica clinica, i MAbs vengono utilizzati in numerose applicazioni diagnostiche e terapeutiche (sia in quanto tali, sia come agenti veicolatori di farmaci su bersagli specifici).
In ambito terapeutico essi vengono impiegati fondamentalmente come agenti:
- Immunosoppressori
- Antineoplastici
- Inibitori dell’angiogenesi
- ADC – Antibody Drugs Coniugate
- Altri (es antiaggreganti)
La nomenclatura degli Anticorpi Monoclonali è uno schema di denominazione utilizzato per assegnare il nome generico (o non-proprietario) agli Anticorpi Monoclonali.
Lo schema di denominazione sotto riportato è utilizzato sia dall'Organizzazione Mondiale della Sanità con l'International Nonproprietary Names (INN) che dagli Stati Uniti con lo United States Adopted Names (USAN) per i prodotti farmaceutici.
Tutti i nomi di un Anticorpo Monoclonale terminano con la desinenza (-MABS). A differenza di molti altri prodotti farmaceutici, la nomenclatura di un Anticorpo Monoclonale usa differenti parti della parola precedente (morfemi) a seconda della struttura e funzione. Questi sono ufficialmente chiamate come sotto-radici (substems) e talvolta erroneamente come infissi (infixes).
I MAbs che saranno prodotti da AEQ PHARMA sono i seguenti:
1. BEVA CI ZU MAB
2. ADA LIM U MAB
3. TRAS TU ZU MAB
4. RITUXIMAB
5. CETUXIMAB
6. PEMBROLIZUMAB
7. ANAKINRA
8. CANAKINUMAB
9. PERTUZUMAB
10.GEMTUZUMAB
Il primo ciclo di MAbs biosimilari e proteine di fusione con date di scadenza del brevetto tra il 2012-2018 include RITUXIMAB, TRASTUZUMAB, ETANERCEPT, INFLIXIMAB, BEVACIZUMAB, CETUXIMAB e ADALIMUMAB.
Sulla base delle ricerche di mercato e della domanda di partnership, AEQ PHARMA sta individuando ulteriori candidati dal prossimo round di MAbs con date di scadenza del brevetto dal 2019 al 2023. Questi includono ABATACEPT, GOLIMUMAB, OFATUMUMAB, AFILBERCEPT, ALEMTUZUMAB, DENOSUMAB, OMALIZUMAB, PALIVIZUMAB, PERTUZUMAB, ECULIZUMAB, TOCILIZUMAB, IPILIMUMAB, RANIBIZUMAB, RAMUCIRUMAB, PEMBROLIZUMAB E NIVOLUMA
M
Anticorpo
UTILIZZO E NOMENCLATURA DEGLI ANTICORPI MONOCLONALI
Nella pratica clinica, i MAbs vengono utilizzati in numerose applicazioni diagnostiche e terapeutiche (sia in quanto tali, sia come agenti veicolatori di farmaci su bersagli specifici).
In ambito terapeutico essi vengono impiegati fondamentalmente come agenti:
- Immunosoppressori
- Antineoplastici
- Inibitori dell’angiogenesi
- ADC – Antibody Drugs Coniugate
- Altri (es antiaggreganti)
La nomenclatura degli Anticorpi Monoclonali è uno schema di denominazione utilizzato per assegnare il nome generico (o non-proprietario) agli Anticorpi Monoclonali.
Lo schema di denominazione sotto riportato è utilizzato sia dall'Organizzazione Mondiale della Sanità con l'International Nonproprietary Names (INN) che dagli Stati Uniti con lo United States Adopted Names (USAN) per i prodotti farmaceutici.
Tutti i nomi di un Anticorpo Monoclonale terminano con la desinenza (-MABS). A differenza di molti altri prodotti farmaceutici, la nomenclatura di un Anticorpo Monoclonale usa differenti parti della parola precedente (morfemi) a seconda della struttura e funzione. Questi sono ufficialmente chiamate come sotto-radici (substems) e talvolta erroneamente come infissi (infixes).
I MAbs che saranno prodotti da AEQ PHARMA sono i seguenti:
1. BEVA CI ZU MAB
2. ADA LIM U MAB
3. TRAS TU ZU MAB
4. RITUXIMAB
5. CETUXIMAB
6. PEMBROLIZUMAB
7. ANAKINRA
8. CANAKINUMAB
9. PERTUZUMAB
10.GEMTUZUMAB
Il primo ciclo di MAbs biosimilari e proteine di fusione con date di scadenza del brevetto tra il 2012-2018 include RITUXIMAB, TRASTUZUMAB, ETANERCEPT, INFLIXIMAB, BEVACIZUMAB, CETUXIMAB e ADALIMUMAB.
Sulla base delle ricerche di mercato e della domanda di partnership, AEQ PHARMA sta individuando ulteriori candidati dal prossimo round di MAbs con date di scadenza del brevetto dal 2019 al 2023. Questi includono ABATACEPT, GOLIMUMAB, OFATUMUMAB, AFILBERCEPT, ALEMTUZUMAB, DENOSUMAB, OMALIZUMAB, PALIVIZUMAB, PERTUZUMAB, ECULIZUMAB, TOCILIZUMAB, IPILIMUMAB, RANIBIZUMAB, RAMUCIRUMAB, PEMBROLIZUMAB E NIVOLUMA
M
Il primo ciclo di MAbs biosimilari e proteine di fusione con date di scadenza del Brevetto tra il 2012-2018 include RITUXIMAB, TRASTUZUMAB, ETANERCEPT, INFLIXIMAB, BEVACIZUMAB, CETUXIMAB e ADALIMUMAB.
Anticorpi per il diabete di tipo 2
Informazioni sul diabete di tipo 2
La condizione è un disturbo endocrino cronico caratterizzato da alti livelli di zucchero nel sangue (iperglicemia) dovuti a effetti ridotti dell'insulina, l'ormone responsabile della regolazione dei livelli di zucchero nel sangue. Il diabete di tipo 2 è considerato indipendente dall'insulina, poiché il problema è la desensibilizzazione delle cellule all'ormone, il che significa che livelli aumentati dell'ormone non migliorano la condizione. Si stima che circa 380 milioni di persone nel mondo soffrano di diabete di tipo 2, che è la maggioranza delle persone affette da diabete. Secondo una stima dell'OMS, più di 1,5 milioni di persone muoiono ogni anno come conseguenza diretta del diabete.1
Potenziale di mercato
L'American Diabetes Association ha recentemente pubblicato un rapporto in cui il costo totale dei pazienti a cui è stato diagnosticato il diabete nel 2017 è stato stimato in 327 miliardi di USD. Ciò includeva 237 miliardi di USD in costi medici diretti e 90 miliardi di USD in produttività ridotta.2 Mentre i fattori di rischio per il diabete di tipo 2 includono predisposizione genetica e obesità, quasi il 90% dei pazienti viene trattato con mezzi farmacologici piuttosto che con soli aggiustamenti dello stile di vita.3 4
Pertanto, si stima che il vasto mercato terapeutico per il diabete di tipo 2 ammonti a oltre 26 miliardi di dollari all'anno nell'UE5 (Francia, Germania, Italia, Spagna e Regno Unito), in Giappone e negli Stati Uniti insieme.
1. Organizzazione Mondiale della Sanità. Rapporto globale sul diabete. Organizzazione Mondiale della Sanità, 2016.
2. American Diabetes Association. “Costi economici del diabete negli Stati Uniti nel 2017.” Diabetes care 41.5 (2018): 917.
3. Sondaggio proprietario sul diabete di Datamonitor Healthcare, maggio 2016.
4. Previsioni di Datamonitor Healthcare: diabete di tipo 2 2016-25
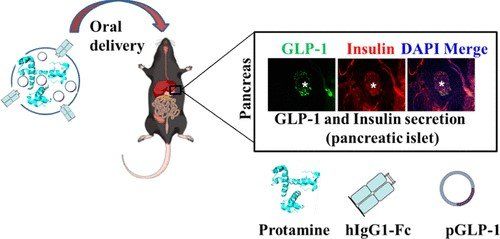
Somministrazione orale mediata da anticorpi di DNA terapeutico per il diabete mellito di tipo 2
Il diabete mellito di tipo 2 (T2DM) è una condizione iperglicemica cronica e progressiva. Il peptide-1 simile al glucagone (GLP1) è un'incretina secreta dalle cellule β del pancreas e aiuta a produrre insulina per bilanciare il livello di glucosio nel sangue senza il rischio di ipoglicemia.
Tuttavia, l'applicazione terapeutica del GLP1 è limitata dalla sua intrinseca breve emivita e dalla rapida eliminazione metabolica dall'organismo.
Per potenziare l'effetto antidiabetico del GLP1, abbiamo progettato un veicolo di somministrazione genica orale mediato da anticorpi IgG1-Fc modificati con cisteina umana, che aiuta a produrre GLP1 in modo sostenibile nel sito bersaglio con l'aiuto di un'emivita aumentata del nanocarrier coniugato con Fc, protegge GLP1 dalla degradazione acida ed enzimatica nel tratto gastrointestinale (GI), assorbe e trasporta la formulazione GLP1 attraverso il recettore Fc neonatale (FcRn) e aiuta a rilasciare il gene GLP1 nell'intestino.
La nostra formulazione potrebbe ridurre la glicemia da una media di circa 320 mg/dL (iperglicemica) a 150 mg/dL (concentrazione normale di glicemia) nei topi diabetici, il che equivale a una riduzione di circa il 50% della concentrazione totale di glicemia.
GLP1 (500 μg) complessato con il carrier IgG1-Fc si è dimostrato la dose ottimale per una riduzione completa delle condizioni iperglicemiche nei topi diabetici. Una quantità significativa di produzione di insulina e la presenza del peptide GLP1 sono state osservate nelle isole pancreatiche dei topi diabetici trattati con formulazione orale GLP1 nell'analisi immunoistochimica rispetto ai topi diabetici non trattati.
La somministrazione di DNA è emersa come una nuova terapia per diverse applicazioni. Abbiamo progettato un frammento di IgG Fc umano ricombinante per ottenere l'assorbimento attivo mediato dal recettore FcRn neonatale (FcRn) e il trasporto del DNA plasmidico (pDNA).
abbiamo sviluppato un sistema di somministrazione orale del gene GLP-1 sulla piattaforma di hIgG1-Fc-9Arg cationico. Un t1/2 prolungato, una minore immunoattività e migliori bioattività dei complessi hIgG-Fc-9Arg/pGLP-1 sembravano essere un approccio promettente per ottenere un trattamento potente del diabete di tipo 2.
Anticorpi monoclonali umani che si legano allostericamente al recettore dell'insulina (INSR): XMetA, XMetS e XMetD
Molti anticorpi monoclonali terapeutici agiscono come antagonisti dei recettori prendendo di mira e bloccando il sito di legame del ligando naturale (sito ortosterico). Al contrario, l'uso di anticorpi per prendere di mira i recettori nei siti allosterici (distinti dal sito ortosterico) non è stato ampiamente studiato.
XMetA attiva direttamente l'INSR da solo o in combinazione con l'insulina. XMetS, al contrario, non attiva direttamente l'INSR ma migliora notevolmente la capacità del recettore di legare l'insulina e potenziare la segnalazione dell'insulina. Sia XMetA che XMetS sono efficaci nel controllo dell'iperglicemia nei modelli murini di diabete.
Un terzo anticorpo allosterico, XMetD, è un inibitore della segnalazione INSR.
Gli anticorpi allosterici contro l'INSR possono modulare la sua segnalazione e correggere le condizioni di disregolazione del glucosio.
Esiste la possibilità che l'uso degli anticorpi allosterici possa essere esteso ad altri recettori per il trattamento dei disturbi metabolici.
Anticorpo terapeutico anti-ACVR2B ADCC (Bimagrumab BYM338)
Questo prodotto è un anticorpo potenziato con ADCC prodotto dalla nostra piattaforma PLANT.
Anticorpo monoclonale umano ricombinante espresso in Plant che si lega all'ACVR2B umano. Bimagrumab è un anticorpo monoclonale umano sviluppato per trattare la perdita e la debolezza muscolare patologica.
Ha come bersaglio il recettore dell'activina di tipo II (ActRII)A e ActRIIB, impedendo il legame con i loro ligandi naturali che regolano negativamente la crescita muscolare, tra cui miostatina, fattore di crescita e sviluppo 11 e activina. È stato utilizzato in studi clinici che studiavano il trattamento e la terapia di supporto della sarcopenia, del muscolo scheletrico, della ventilazione meccanica, della miosite sporadica da corpi inclusi e della miosite sporadica da corpi inclusi (sIBM), tra gli altri.
Anticorpo monoclonale anti-SeP umano AE2
Anticorpo monoclonale anti-SeP umano AE2 con attività neutralizzante contro SeP
La selenoproteina P (SeP) funziona come una proteina che fornisce selenio (Se).
SeP è identificato come un'epatochina, che promuove la resistenza all'insulina nel diabete di tipo 2. Pertanto, la soppressione dell'attività Sesupply di SeP potrebbe migliorare il metabolismo del glucosio. Qui, sviluppiamo un anticorpo monoclonale anti-umano SeP AE2 con attività neutralizzante contro SeP. La somministrazione di AE2 ai topi migliora significativamente l'intolleranza al glucosio e la resistenza all'insulina indotte dalla somministrazione di SeP umano. Inoltre, la somministrazione eccessiva di SeP riduce significativamente i livelli di insulina nel pancreas e l'elevata secrezione di insulina indotta dal glucosio, che vengono migliorati da
Somministrazione di AE2. La mappatura degli epitopi rivela che AE2 riconosce una regione di SeP umana adiacente alla prima regione ricca di istidina (FHR). Un anticorpo policlonale contro la SeP FHR del topo migliora l'intolleranza al glucosio e la secrezione di insulina in un modello murino di diabete. Questo rapporto descrive una nuova strategia molecolare per lo sviluppo di terapie per il diabete di tipo 2 mirate a SeP.
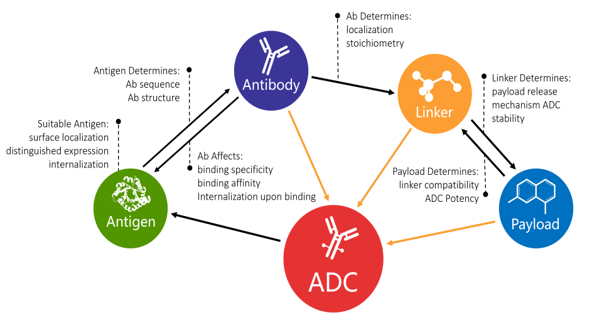
Coniugato farmaco-anticorpo
L'anticorpo dirige l'ADC a colpire specifiche cellule tumorali e la funzione dei piccoli farmaci per uccidere le cellule tumorali mirate. Pertanto, l'ADC ha sia la specificità dell'anticorpo sia la tossicità dei farmaci per rimuovere con precisione le cellule tumorali. Combinando il vantaggio sia dell'anticorpo che dei piccoli farmaci, l'ADC offre la migliore qualità, riducendo i potenziali danni.
La tecnologia ADC sfrutta la selettività degli anticorpi monoclonali (MAbs) per offrire nuove possibilità ai malati di cancro; questo approccio è stato approvato nella gestione di neoplasie ematologiche selezionate e tumori solidi.
Gli ADC possono essere un veicolo efficace e mirato progettato per fornire potenti agenti citotossici direttamente alle cellule tumorali attraverso il legame selettivo di anticorpo.
ADC con citotossina
La preparazione di ADC viene comunemente eseguita attraverso una reazione in due fasi:
L'anticorpo reagisce con un legante coniugato per generare un intermedio anticorpo-legante
L'intermedio anticorpo-linkante reagisce con il piccolo farmaco formando il coniugato anticorpo-farmaco finale
Le immunoterapie monoclonali a base di anticorpi contro il cancro e altre malattie infettive sono altamente vantaggiose rispetto agli approcci terapeutici convenzionali a causa della loro alta specificità e affinità verso obiettivi ben definiti.
Gli ADC ereditano tali superiorità e, più straordinariamente, espandono la finestra terapeutica dei farmaci coniugati (Payloads), che di solito sono altamente tossici e diversi nella loro natura biochimica.
La progettazione di un ADC è un processo elaborato che prevede un'attenta pianificazione, un'esecuzione meticolosa e un'intensa risoluzione dei problemi. Una combinazione efficace dei componenti più adatti aumenterà notevolmente le possibilità di successo di un ADC. Con questo concetto in mente, AEQ PHARMA ha perfezionato i servizi di sviluppo ADC suddividendoli in sei moduli indipendenti ma interconnessi, proprio come la relazione tra ciascun componente di un ADC.
Al punto di partenza di un progetto di sviluppo di ADC, offriamo servizi di screening degli anticorpi, tra cui la consultazione nella selezione degli antigeni, lo screening degli anticorpi specifici per antigene, la selezione degli anticorpi interni, nonché la convalida della fattibilità di prove di concetto utilizzando "ADC Anti-Ab".
Un farmaco adatto per il carico utile verrà selezionato e accoppiato con un linker con il meccanismo di rilascio desiderato in "DrugLnk" per assemblare la "testata chimica" per un ADC, che viene successivamente coniugato con l'anticorpo desiderato utilizzando i servizi di progettazione e coniugazione degli anticorpi.
INTERLEUCINA (IL-11; IL4; IL2)
Interleukin-11 (IL-11) è una citochina che svolge un ruolo regolatore chiave nel sistema immunitario. L'IL-11 umano ricombinante (rhIL-11) esercita un effetto preventivo contro la morte cellulare apoptotica e inibisce la differenziazione dei preadipociti.
L'IL-11 viene anche utilizzato per stimolare il midollo osseo a produrre piastrine al fine di prevenire le piastrine basse che potrebbero essere causate dalla chemioterapia.
Sfortunatamente, IL 11 ha un elevato costo di produzione.
La produzione di proteine rhIL-11 nel sistema di espressione di piante sarà più economica se confrontata con l'attuale sistema di espressione basato su E. coli.
Il gene umano rhIL-11 è stato codonato ottimizzato per massimizzare l'espressione del sistema ospite centrale. Il vettore di espressione di IL-11 sotto il controllo di un promotore costitutivo del virus del mosaico del cavolfiore 35S (CaMV 35S) è stato introdotto nel Nicotiana benthamiana mediante la trasformazione di Agrobacteriummediated. La sequenza 5'-leader (chiamata O) del virus del mosaico del Nicotiana benthamiana (TMV) come potenziatore traslazionale è stata aggiunta per costruire.
Sono state generate piante di Nicotiana benthamiana transgeniche che esprimono vari livelli di proteina rhIL-11. Il western blotting delle linee trasformate stabilmente ha dimostrato l'accumulo della proteina rhIL-11 di dimensioni appropriate nelle foglie. Questa ricerca ha dimostrato l'efficacia dell'uso del Nicotiana benthamiana come sistema di espressione per la produzione di rhIL-11.
IL-4
Interleukin-4 (IL-4) è una citochina pleiotropica che svolge un ruolo regolatore chiave nel sistema immunitario. L'IL-4 umano ricombinante (rhIL-4) offre un grande potenziale per il trattamento del cancro, delle malattie virali e autoimmuni.
Sfortunatamente, l'elevato costo di produzione di IL-4 associato ai sistemi di espressione convenzionali ha finora limitato test clinici più ampi, in particolare per quanto riguarda la somministrazione orale più conveniente e più sicura di IL-4 rispetto all'iniezione parenterale nei pazienti.
Si possono produrre tabacchi transgenici che esprimono vari livelli di proteina rhIL-4. Un'espressione più elevata è stata ottenuta attraverso la ritenzione di IL-4 nel reticolo endoplasmatico (ER), con l'accumulo massimo pari a circa lo 0,1% della proteina solubile totale (TSP) nelle foglie.
Questi risultati suggeriscono che le piante possono essere utilizzate per produrre rhIL-4 biologicamente attiva.
Particelle simili a virus di Aequilibriu Pharma
Produzione di particelle simili a virus (VLP) nel sistema vegetale

Particelle simili a virus (VLP) per lo sviluppo di vaccini
IL NOSTRO NANOBODY VHH SINTETICO (Abs VHH a catena singola)
Aeqpharma seleziona e convalida nanobodies derivati da una libreria di anticorpi VHH umani completamente sintetica e proprietaria. Gli anticorpi VHH a catena singola (nanobodies) possono essere facilmente fusi a un tag (ad esempio marcatori fluorescenti, enzimi, specie multi-Fc) dando origine a nanobodies ricombinanti completamente funzionali per un'ampia gamma di applicazioni in vitro e in vivo.
PROPRIETÀ DEI NANOCORPI VHH
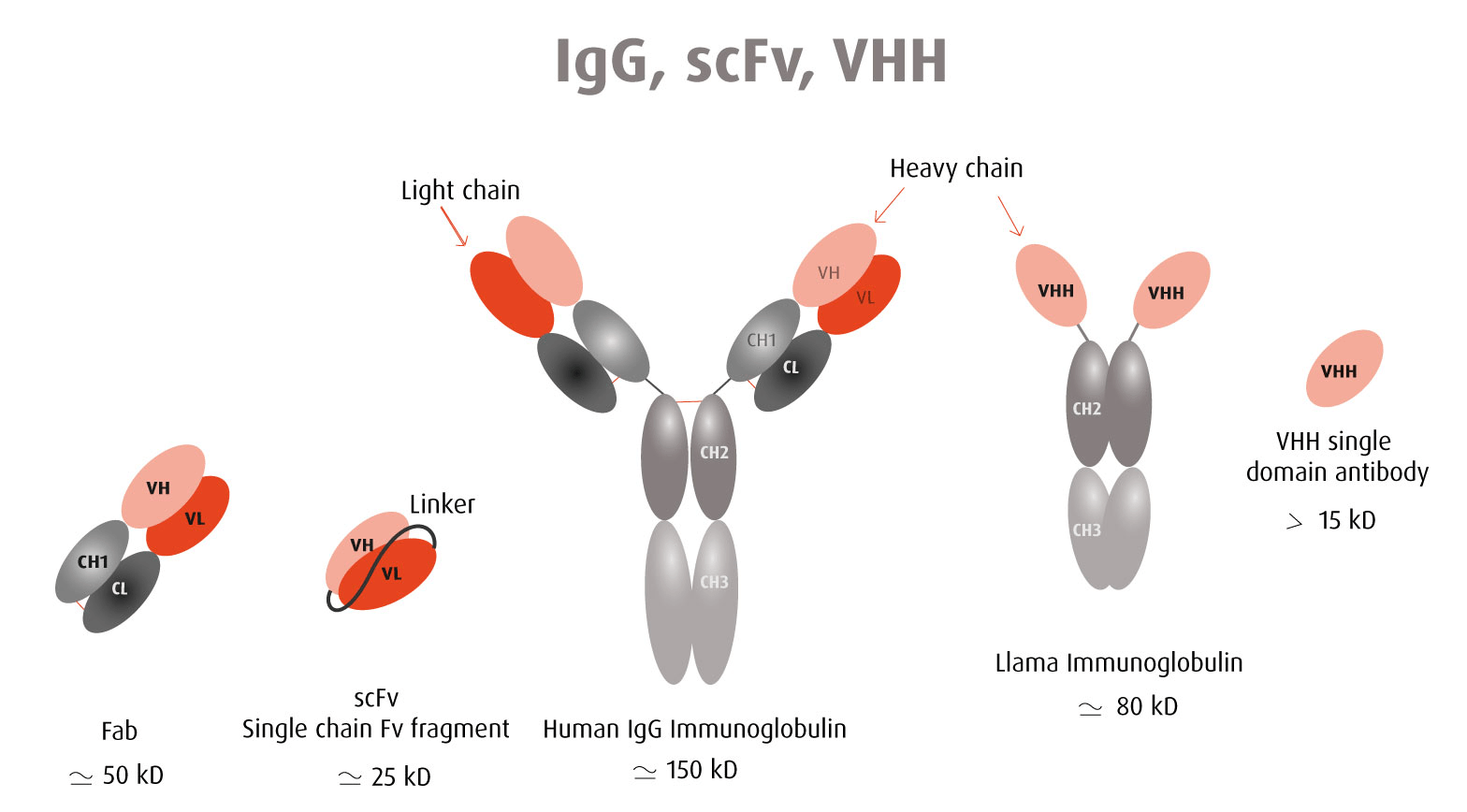
Gli anticorpi monoclonali sono molecole di grandi dimensioni di circa 150 kDa e talvolta ciò limita il loro utilizzo in analisi con diversi reagenti che competono per il riconoscimento di epitopi ravvicinati. A causa di queste limitazioni, è emerso l'uso di molecole derivate da anticorpi più piccole.
Confronto tra un anticorpo VHH e un'immunoglobulina completa
Gli anticorpi a frammento variabile a catena singola (scFv) sono stati comunemente usati come alternative. Gli ScFv sono costituiti solo dalle regioni variabili della catena leggera e della catena pesante delle immunoglobuline collegate da un linker peptidico. Il loro peso molecolare medio è di circa 27 kDa. Gli ScFv contengono il sito di legame dell'antigene e sono asspecifici e affini come gli anticorpi intatti.
Più di recente, anticorpi a dominio singolo sono stati isolati da animali camelidi; i cosiddetti VHH. Un anticorpo VHH corrisponde alla regione variabile di una catena pesante di un anticorpo camelide e ha una dimensione molto piccola di circa 15 kDa, da cui il nome "nanobody".
Il vantaggio di queste molecole derivate da anticorpi è la loro piccola dimensione che consente il legame con epitopi nascosti non accessibili agli anticorpi interi. Nel contesto delle applicazioni terapeutiche, un piccolo peso molecolare significa anche una penetrazione efficiente e una rapida clearance. Un nanobody VHH ha una maggiore probabilità di adottare un identico folding intra- ed extracellulare. Pertanto, è un candidato qualificato per il sondaggio intracellulare (Intrabody).
Essendo una molecola di anticorpo a dominio singolo, un nanobody VHH viene espresso nella cellula senza la necessità di un assemblaggio sopramolecolare, a differenza di un'immunoglobulina completa composta da 4 catene, 2 catene leggere e 2 catene pesanti. Un nanobody VHH è più stabile e robusto di un anticorpo intero.
Sia i nanobodies scFv che VHH possono essere legati al frammento Fc della specie desiderata e mantenere la loro specificità e proprietà di legame (Minibody).