Bio-better/PEGilazione
Un biobetter è un prodotto biologico che è stato modificato strutturalmente e/o funzionalmente per ottenere una prestazione clinica migliorata o diversa rispetto a un prodotto biologico originale (innovatore) già approvato. I biobetter mirano allo stesso target (ad esempio recettore, enzima) del prodotto innovatore. Le modifiche utilizzate nella progettazione dei biobetter di solito includono modifiche chimiche (ad esempio PEGilazione) o una nuova formulazione (ad esempio una nuova via di somministrazione, rilascio modificato). I miglioramenti possono comportare un'emivita più lunga (che consente un dosaggio meno frequente), una migliore efficacia e/o sicurezza o una ridotta immunogenicità. A seconda del loro livello di innovazione e di quanto bene soddisfano un'esigenza medica definita e insoddisfatta, i biobetter possono ottenere brevetti ed esclusività dei dati. La tecnologia di PEGilazione può essere utilizzata per modificare composti biologici come citochine, frammenti di Anticorpi, interleuchine, ormoni, oligonucleotidi e alcune proteine e peptidi. La PEGilazione può essere efficace per migliorare la biodisponibilità, prolungare la circolazione sanguigna, massimizzare la farmacocinetica, abbassare l'immunogenicità e diminuire la frequenza di dosaggio. AQUILIBRIUM PHARMA fornisce PEG attivati ad alte prestazioni per i farmaci PEGylated dalla fase di sviluppo iniziale a quella commerciale grazie alla collaborazione con partner con esperienza ventenale nella produzione di metossipolietilenglicole di alta qualità, un materiale di partenza chiave del PEG attivato in campo farmaceutico. I nostri PEG attivati hanno una stretta polidisperità e un basso contenuto di diolo con una vasta gamma di pesi molecolari, che vanno da 2kDa a 80kDa. I biomigliori sono prodotti attraverso modifiche chimiche o molecolari del prodotto originario mediante cambiamenti funzionali che possono includere aumento dell'emivita, ridotta tossicità, ridotta immunogenicità e miglioramento della farmacocinetica e/o della farmacodinamica. Questa nuova categoria di biologici migliori è emersa negli ultimi anni e ha attirato l'attenzione dell'industria, principalmente per il loro ridotto rischio commerciale, poiché sono brevettabili e valgono prezzi più alti per i loro vantaggi clinici (Courtois et al., 2015; Lagassé et al., 2017). I biosimilari, d'altro canto, sono biologici con la stessa efficacia del farmaco originale a un prezzo ridotto. Tuttavia, non hanno diritto alla protezione brevettuale o all'esclusività dei dati (Kadam et al., 2016; Sandeep et al., 2016). I biosimilari mirano a stabilire la somiglianza con un biologico noto. La Figura 1 illustra un confronto generale tra biosimilari e biobetter in termini di proprietà e aspetti economici/normativi. In questa revisione verranno esplorate le principali strategie per lo sviluppo di biobetter ASNase fornendo una panoramica aggiornata ed evidenziando le sfide e le opportunità intrinseche.
Biomeglio di PegAspargase
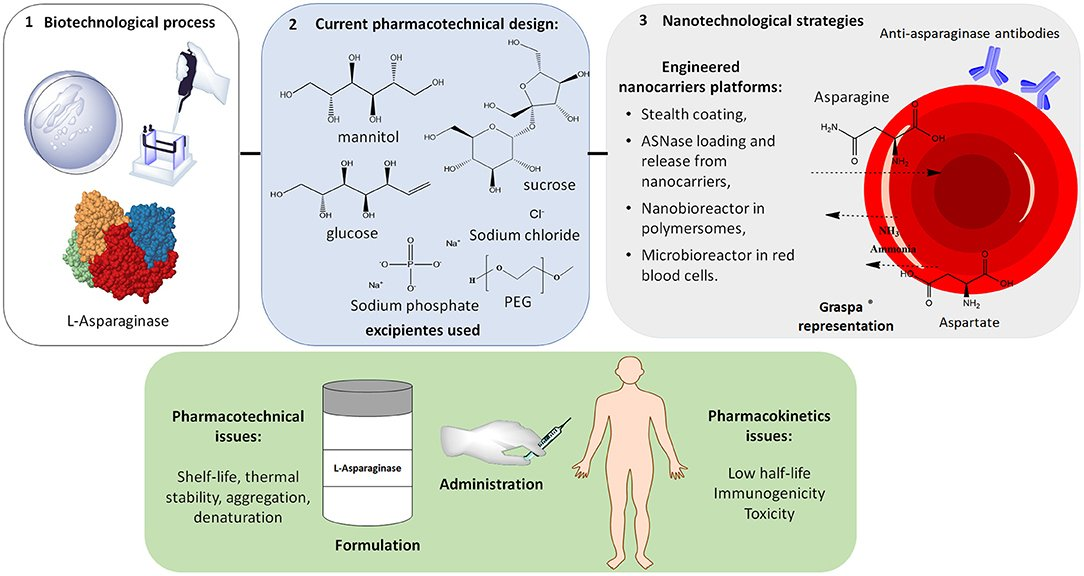
Proteina PEGilazione La PEGilazione è una tecnica importante per lo sviluppo di biofarmaci con un profilo di qualità migliorato, come prioritario dai principi QbD (Turecek et al., 2016). Sebbene la PEGilazione sia stata descritta per la prima volta alla fine degli anni '70 da Franck Davis e dai suoi colleghi (Abuchowski et al., 1977; Hoffman, 2016), stanno emergendo nuove frontiere per questa tecnologia, attraverso i progressi nella chimica della PEGilazione e l'estensione a una pletora di nuovi biofarmaci basati sulle proteine (Ryu et al., 2012; Ginn et al., 2014; Swierczewska et al., 2015). La PEGilazione proteica consiste nell'unione del polietilenglicole (PEG), un polimero approvato dalla FDA, a un farmaco a base proteica, con l'obiettivo di migliorare l'emivita circolatoria riducendo la velocità di filtrazione glomerulare (Ginn et al., 2014; Kolate et al., 2014; Turecek et al., 2016). Le proteine PEGilate sono nate nel campo biofarmaceutico nel tentativo di migliorare le proprietà cliniche dei prodotti biologici a base proteica in termini di aumento dell'emivita circolatoria senza influenzare l'attività biologica (Ginn et al., 2014; Turecek et al., 2016). Non solo l'aumento dell'emivita del farmaco è stato visto come un vantaggio della PEGilazione, ma anche il miglioramento dell'efficacia terapeutica dei farmaci, attraverso diversi altri effetti benefici, come descritto nella Figura 3 (Harris e Chess, 2003; Ginn et al., 2014; Swierczewska et al., 2015; Turecek et al., 2016). La PEGilazione diminuisce l'aggregazione proteica aumentandone l'idrofilia, diminuendo la degradazione proteolitica e il riconoscimento da parte degli anticorpi anti-farmaco. Tuttavia, la PEGilazione può influenzare negativamente l'attività in vitro dei biologici a base di proteine. Questo effetto può essere compensato nei sistemi biologici dal periodo più lungo di circolazione del farmaco nei vasi sanguigni (Turecek et al., 2016). La pegaspargasi è un enzima modificato. È una forma di L-asparaginasi che ha subito la PEGilazione. È utilizzato come farmaco chemioterapico per il cancro ("antineoplastico" o "citotossico") ed è indicato per il trattamento della leucemia linfatica acuta (LLA), del linfoma non-Hodgkin e per il trattamento di pazienti che hanno avuto una reazione di ipersensibilità a un'altra forma di asparaginasi. Il prodotto originale, Oncaspar (pegaspargasi) di Baxalta, è stato approvato dalla Food and Drug Administration (FDA) negli Stati Uniti nel febbraio 1994 e dall'Agenzia europea per i medicinali (EMA) nel gennaio 2016. Baxalta, leader mondiale nella biotecnologia, ha acquisito Oncaspar nel luglio 2015. Il farmaco ha venduto 87 milioni di dollari USA per Baxalta nel 2015, con un fatturato storico annuo di circa 1 miliardo di dollari USA. Oncaspar non sembra essere coperto da alcun brevetto.
Tendenze attuali nello sviluppo di nuove L-asparaginasi biomigliori
Sono stati segnalati studi che considerano altri tipi di bioconiugati volti al miglioramento del profilo di qualità dell'ASNase (vale a dire, le sue proprietà farmacocinetiche e immunologiche) e alla produzione di nuove ASNasi biomigliori. Tabandeh e Aminlari (2009) hanno studiato la coniugazione dell'ASNase con inulina ossidata e sono state osservate caratteristiche farmacocinetiche e fisico-chimiche migliorate, come resistenza alla digestione della tripsina e maggiore stabilità termica, emivita più lunga, migliore riutilizzabilità dopo ripetuti congelamenti e intervallo di pH ottimale più ampio rispetto a quello dell'ASNase nativa. Inoltre, la bioconiugazione ha determinato una diminuzione del titolo anticorpale (IgG) e dell'immunogenicità dopo ripetute iniezioni di conigli rispetto all'ASNase nativa. Zhang et al. (2005) hanno preparato bioconiugati fibroina della seta-ASNasi che presentavano immunogenicità e antigenicità ridotte, buona attività residua (quasi l'80%), maggiore stabilità termica e di conservazione, resistenza alla digestione con tripsina e emivita più lunga (63 h) rispetto all'enzima nativo (33 h). Tuttavia, nessuno di questi nuovi bioconiugati è stato ancora sottoposto a sperimentazioni cliniche. Nel 2017, un'azienda biofarmaceutica irlandese ha stipulato un accordo di licenza sulla tecnologia PASylation® per sviluppare un'ASNasi ad azione più prolungata. La PASylation si basa su polipeptidi composti da Pro, Ala e, in alternativa, Ser (PAS), che, in condizioni fisiologiche, non hanno una struttura ordinata e formano una spirale casuale con proprietà biofisiche sorprendentemente simili al PEG. Inoltre, a causa dei gruppi laterali metilico (Ala) e trimetilenico (Pro) chimicamente inerti, questi polipeptidi sono privi di qualsiasi reattività della catena laterale (Ahmadpour e Hosseinimehr, 2018; Gebauer e Skerra, 2018). Sono in fase di sviluppo due nuove ASNasi PEGilate: PEG-crisantaspase (Asparec®) e Calaspargase Pegol, come farmaci PEGilati di seconda generazione. Nel 2018 sono iniziati gli studi clinici di fase II e III di PEG-crisantaspase e, come riportato in precedenza, il loro scopo è somministrare questo biofarmaco come terapia di seconda linea nei casi di ipersensibilità all'ASNase di E. coli. Di recente, la FDA ha accettato la domanda di licenza biologica (BLA) per una nuova ASNasi biomigliore: Calaspargase Pegol. In questo caso, il linker SS del PEG reattivo impiegato per la PEGilazione dell'ASNase è stato sostituito da un linker carbammato succinimidile, creando un bioconiugato più stabile.
API biologiche e chimiche
Aequilibrium Pharma continua a essere un partner di fiducia per le aziende farmaceutiche, che si affidano ai nostri principi attivi farmaceutici (API) Small Molecules complessi e difficili da realizzare per la loro formulazione che spazia da immunosoppressori, antimicotici, antidiabetici e oncologici ecc. Ci impegniamo a costruire un valore di marca significativo nella nostra vasta base di clienti sia nei mercati sviluppati che in quelli emergenti sfruttando i nostri punti di forza tecnologici unici nella chimica complessa. Abbiamo la capacità di sintetizzare steroidi complessi, API complesse, API deuterate e carboidrati complessi ecc.
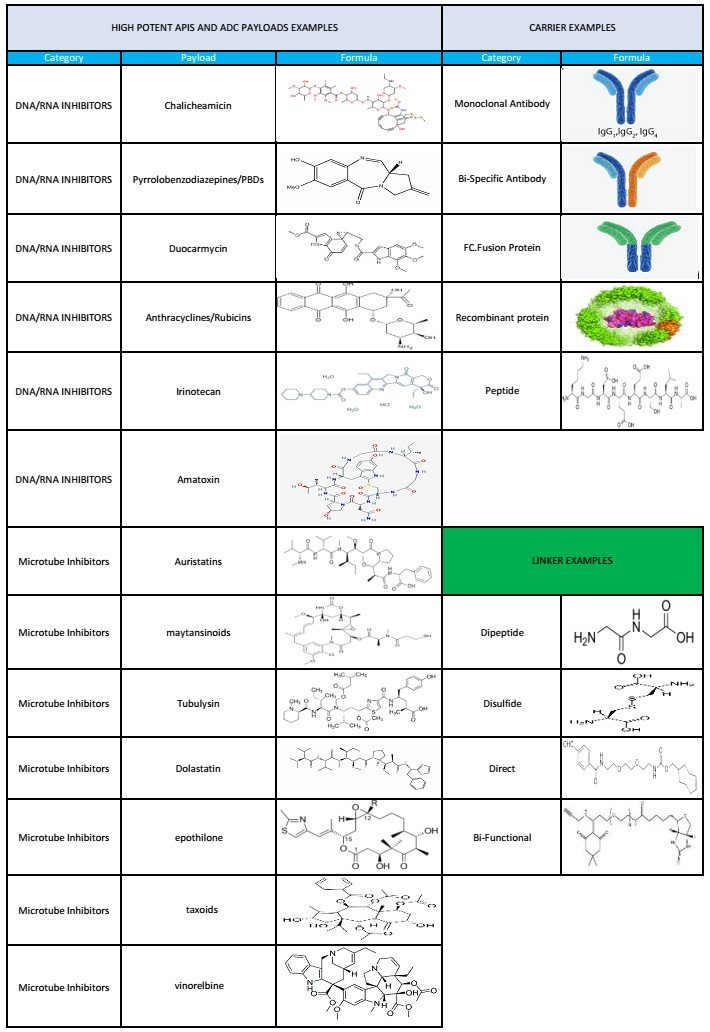
Come uno dei pionieri nella produzione a contratto di anticorpi monoclonali (mAb) e proteine ricombinanti Plant, Aeq Pharma produce gli ingredienti essenziali per i farmaci salvavita di domani in quattro strutture multi-prodotto cGMP all'avanguardia. I nostri clienti spaziano da aziende farmaceutiche internazionali e grandi aziende biotecnologiche a nuove start-up. In AEQ PHARMA, siamo preparati a soddisfare le esigenze del mercato e dei nostri clienti per fornire la migliore soluzione per la tua pipeline. I servizi di R&S di processo di AEQ spaziano dalla costruzione di vettori e sviluppo di linee cellulari alla produzione su larga scala. Questi includono una gamma completa di servizi analitici e supporto normativo per sperimentazioni cliniche e fornitura sul mercato. Abbiamo una vasta gamma di tecnologie di sviluppo all'avanguardia disponibili per migliorare il nostro processo di espressione. Dai primi programmi di valutazione del rischio del target proteico alla nostra espressione genica GS continuamente aggiornata e altamente efficiente, siamo in grado di ottenere titoli più elevati, migliorando al contempo la velocità di commercializzazione, la sicurezza e i costi. Offriamo una linea completa di capacità di sviluppo e produzione dal DNA al BLA. Inoltre, disponiamo di una gamma completa di servizi per la produzione di coniugati farmaco-anticorpo. In collaborazione con la nostra struttura chimica di Visp, possiamo produrre il tuo mAb di interesse e coniugarlo al farmaco di tua scelta. Nuovi approcci alla coniugazione Grazie agli sforzi di ricerca e sviluppo di AEQ, abbiamo sviluppato un nuovo linker per la coniugazione basata sulla lisina che dimostra una maggiore reattività, una migliore solubilità e un intervallo più flessibile di temperature di coniugazione. Questo linker offre la possibilità di coniugarsi ad altre molecole oltre alle IgG. Inoltre, abbiamo sviluppato una chimica del payload unica per fornire un caricamento del farmaco più omogeneo per la coniugazione basata sulla cisteina.
CICLODESTRINA
Sottotitolo
Alfa-ciclodestrina Beta-ciclodestrina Gamma-ciclodestrina Esakis-(6-Mercapto-6-deossi)-alfa-ciclodestrina Esakis-(6-Iodo-6-Deossi)-alfa-ciclodestrina Idrossipropil-alfa-ciclodestrina; HPACD Idrossipropil-beta-ciclodestrina; HPBCD (2-idrossipropil)-alfa-ciclodestrina; HP-A-CD; Idrossipropil-gamma-ciclodestrina; HP-G-CD; Sale sodico di carbossimetil-beta-ciclodestrina; CM-B-CD Idrossietil-beta-ciclodestrina; HE-B-CD Metil-beta-ciclodestrina; Me-B-CD Mono-(6-ammino-6-deossi)-beta-ciclodestrina Eptakis(6-ammino-6-deossi)-beta-ciclodestrina Mono-(6-mercapto-6-deossi)-beta-ciclodestrina Mono-(6-(tetraetilenpentammina)-6-deossi)-beta-ciclodestrina Allil-beta-ciclodestrina Oligo(acido lattico)-beta-ciclodestrina Idrossibutil-beta-ciclodestrina Vanillina-beta-ciclodestrina Metnol-idrossipropil-beta-ciclodestrina Acido salicilico-idrossipropil-beta-ciclodestrina Acido azelaico-beta-ciclodestrina Nicotina-beta-ciclodestrina Personalizza ciclodestrine modificate
MACROLIDE
Sottotitolo
Vancomicina cloridrato Teicoplanina Tobramicina solfato Tobramicina base Moxidectina Daptomicina Imiquimod Docetaxel Moxifloxacina cloridrato Cabazitaxel Colistimato sodico Zinco bacitracina Natamicina
Meccanismi alla base dell'azione e della sinergia di Trastuzumab e Pertuzumab nel trattamento del carcinoma mammario HER2-positivo.
Il recettore del fattore di crescita epidermico umano (HER) 2 (HER2) è sovraespresso nel 20-30% dei tumori al seno. HER2 è un bersaglio preferito per il trattamento del tumore al seno HER2-positivo. Trastuzumab e Pertuzumab sono due anticorpi monoclonali mirati a HER2 approvati dalla Food and Drug Administration (FDA) per l'uso come terapia adiuvante in combinazione con docetaxel per il trattamento del tumore al seno HER2-positivo metastatico. L'aggiunta di anticorpi monoclonali al regime di trattamento ha cambiato il paradigma per il trattamento del tumore al seno HER2-positivo. Nonostante il miglioramento dei risultati, la percentuale di pazienti che traggono beneficio dal trattamento è ancora bassa. Sono necessarie ricerche e sviluppo continui di nuovi agenti e strategie di combinazioni di farmaci. Una conoscenza approfondita dei meccanismi molecolari alla base dell'azione e del sinergismo di trastuzumab e pertuzumab è essenziale per andare avanti e raggiungere un'elevata efficacia nel trattamento del tumore al seno HER2-positivo. Questa revisione ha esaminato e analizzato i risultati e le ipotesi riguardanti l'azione e il sinergismo di trastuzumab e pertuzumab e ha proposto un modello di sinergismo basato sulle informazioni disponibili.